Författare:
Randy Alexander
Skapelsedatum:
4 April 2021
Uppdatera Datum:
16 Maj 2024
Innehåll
Molekylformeln är en viktig data i vilken kemisk förening som helst. Den indikerar vilka atomer som finns i den och, ännu mer, i vilken mängd. Du måste känna till den empiriska formeln för att beräkna molekylformeln, och du måste förstå att skillnaden mellan dem är en heltalsmultiplikator.
Steg
Metod 1 av 3: härleda molekylformeln från en empirisk formel
Känner till förhållandet mellan båda. Den empiriska formeln anger en relativ proportion till atomerna i en molekyl - till exempel två syre för varje kol. Molekylformeln anger i sin tur hur många av dessa atomer som finns i molekylen - till exempel ett kol och två syre (koldioxid). Båda är relaterade till ett heltal, så att den empiriska formeln, multiplicerad med proportionen, resulterar i molekylformeln.

Beräkna mängden mol i en gas. För detta måste den ideala gaslagen användas. Du kan bestämma mängden mol utifrån tryck-, volym- och temperaturdata som finns i experimentdata. Denna mängd kan beräknas enligt följande:- I ekvationen representerar den mängden mol, representerar trycket, representerar volymen, representerar temperaturen (i Kelvin) och är gaskonstanten.
- Exempel:

Beräkna gasens molekylvikt. Detta kan endast göras efter att mängden mol närvarande gas har fastställts (med den ideala gaslagen). Du bör också veta hur många gram gas som finns. Sedan delar du bara mängden i gram med mängden i mol för att bestämma molekylvikten.- Exempel:

Lägg till atomvikten för alla atomer i den empiriska formeln. Varje atom i denna ekvation har sin egen atomvikt. Detta värde kan hittas vid basen av atomramen, i den periodiska tabellen. Lägg till dessa vikter tillsammans för att bestämma vikten av den empiriska formeln.- Exempel:
Bestäm andelen mellan vikterna i molekylformeln och i den empiriska formeln. På detta sätt kan du bestämma hur många gånger den empiriska formeln upprepas i molekylen. Att känna till antalet repetitioner hjälper dig att förstå antalet situationer där den empiriska formeln visar sig i molekylformeln. Värdet i fråga måste vara ett heltal. Om andelen inte avrundas till ett heltal måste du runda resultatet.
- Exempel:
Multiplicera den empiriska formeln med förhållandet. Multiplicera den empiriska formeln med förhållandet. Detta kommer att resultera i molekylformeln. Observera att för alla föreningar med förhållandet "" kommer de empiriska och molekylära formlerna att vara identiska.
- Exempel:
Metod 2 av 3: Bestämning av den empiriska formeln
Hitta massan för varje närvarande atom. I vissa situationer kommer massan för varje atom att ges. I andra kommer det att uttryckas som en procentuell massa. Om detta är fallet är det möjligt att anta att det är ett prov som innehåller den förening som analyseras. Detta gör att du kan skriva den procentuella massan som massan själv, i gram.
- Exempel:
Konvertera massorna till mol. Du måste konvertera molekylmassorna för varje element till mol. För det är det nödvändigt att dela dem med respektive atommassa för var och en av dem. Du kan hitta detta värde längst ner i tabellen för varje element i den periodiska tabellen.
- Exempel:
- Exempel:
Dela upp alla molära värden med den minsta. Det är nödvändigt att dela upp mängden mol motsvarande varje element separerat med den minsta molära mängden som finns i hela föreningen. På så sätt kan du hitta enkla proportioner att arbeta med. Detta fungerar mycket bra eftersom det bestämmer att det minsta värdet ska vara lika med "", vilket ger de andra elementen en relativ proportion.
- Exempel: den minsta molära mängden är syre med.
- Exempel: den minsta molära mängden är syre med.
Runda molvärden till hela siffror. Dessa nummer blir de prenumererade värdena i din empiriska formel. Du måste runda dem till närmaste heltal respektive. Efter denna viktiga bestämning kommer det att vara möjligt att skriva den empiriska formeln.
- Exempel: den empiriska formeln skulle vara.
- Exempel: den empiriska formeln skulle vara.
Metod 3 av 3: Förstå kemiska formler
Förstå den empiriska formeln. Det ger dig data angående förhållandet mellan en atom till en annan i en given molekyl. Det finns emellertid ingen information om mängden atomer som finns i molekylen. Den empiriska formeln ger inte heller information om strukturen och bindningarna mellan dessa atomer.
Förstå vad molekylformeln säger till dig. Liksom med den empiriska formeln ger molekylformeln inte data om en molekyls bindningar och struktur. Men det ger detaljer om mängden av varje atom som finns i den. Empiriska och molekylära formler avser en andel uttryckt med ett heltal.
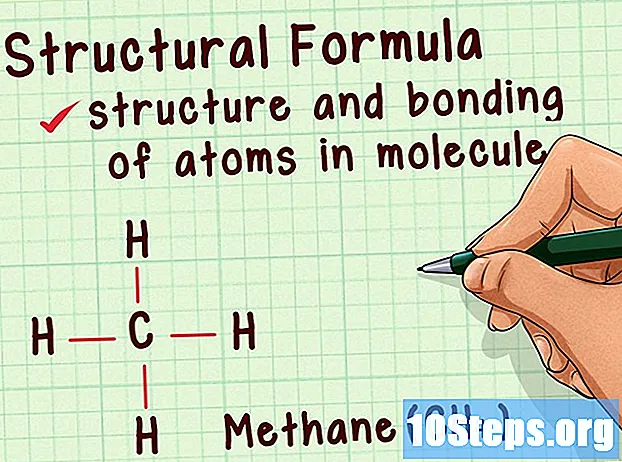
Förstå strukturella representationer. De ger dig ännu mer information än molekylformler. Förutom att avslöja mängden atomer som finns i molekylen, informerar de strukturella representationerna om bindningarna och strukturen själv. Dessa data är avgörande för att förstå hur molekylen kan reagera.
tips
- Läs frågan (eller uppgifterna) noggrant.
varningar
- Förväxla inte den empiriska formeln med molekylformeln och vice versa.
Nödvändiga material
- Periodisk tabell över element;
- Kalkylator;
- Penna;
- Papper.